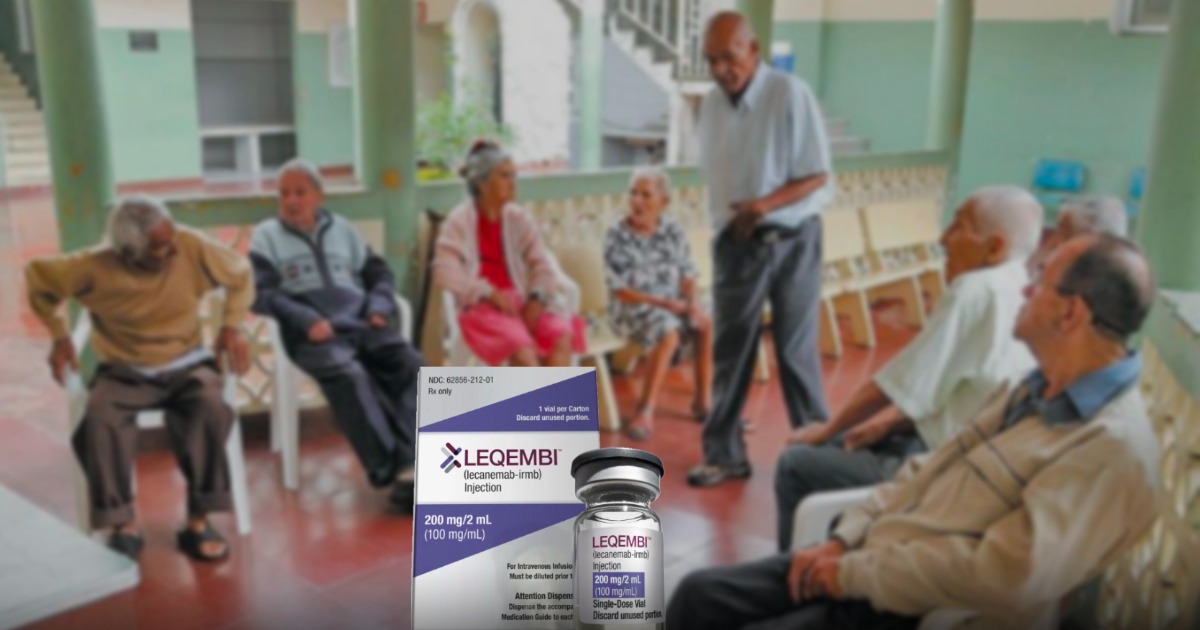
El año 2023 arrancó con una noticia promisoria para los millones de adultos mayores que sufren de Alzheimer, una enfermedad degenerativa que destruye la capacidad cognitiva de quien la padece. La FDA, autoridad que regula el uso de los medicamentos en Estados Unidos, aprobó, de emergencia, un fármaco del laboratorio Biogen. El mismo que hace dos años lanzó al mercado otro medicamento para el Alzheimer (Aduhelm) que no funcionó y terminó siendo recogido por el laboratorio. Superados obstáculos, los resultados parecen ser esta vez mucho más prometedores.
El proceso de aprobación fue más rápido de lo normal, como ocurrió en su momento con las vacunas contra la Covid-19.
Diversos ensayos clínicos evidenciaron que este medicamento puede reducir ligeramente el deterioro cognitivo, lo que podría representar una ralentización de la progresión de la enfermedad. El médico especialista en neurología vascular, Hernán Bayona, explica que esto se logra por medio de la inhibición de los depósitos de monómeros de amiloide. Este es uno de los procesos que han sido utilizados para interpretar el desarrollo de la enfermedad del Alzheimer.
No obstante, Bayona advierte que la evidencia puede no ser lo suficientemente contundente. Sus principales reservas recaen sobre el perfil de seguridad del medicamento, ya que se ha detectado una cantidad considerable de casos de edema y de hemorragia cerebral.
Lecanemab, principio activo de Leqembi, solo ha sido estudiado en personas con Alzheimer en fase temprana. Es decir, aquellos que pudiendo tener episodios de pérdida de memoria, aún cuentan con la capacidad de realizar sus actividades de forma independiente. Esto refuerza la importancia de realizar un diagnóstico temprano, ya que cerca del 75% de los pacientes con Alzheimer no son diagnosticados a tiempo.
Lo cierto es que, a pesar de su perfil de seguridad mejorable y de que no tiene la capacidad de curar la enfermedad por completo, Leqembi irradia la mayor luz de esperanza para los pacientes con Alzheimer en décadas.

Leqembi es una nueva esperanza para los pacientes con Alzheimer
Por lo pronto, solo estará indicado para pacientes en fase temprana de la enfermedad y, al contar únicamente con la aprobación de la FDA, solo podrá conseguirse en Estados Unidos por cerca de USD 26.000 al año. Aunque el precio es inferior al que tuvo aducanumab, existe la preocupación de que se convierta en un medicamento muy costoso para ser usado masivamente en países de bajos y medianos ingresos como Colombia.
Está pendiente la aprobación por parte de otras agencias regulatorias como el INVIMA y particularmente la de la Agencia Europea de Medicamentos (EMA). La cual, en su momento, le puso objeciones a la comercialización de Aduhelm, lo que llevó a que el laboratorio Biogen no saliera adelante con este producto y que nunca llegara a Colombia.
Vea también:
VIDEO: Anciano con Alzheimer cree que aplausos por médicos de Coronavirus son para él
Anuncios.
Anuncios.